Aatomiline ja molekulaarne struktuur
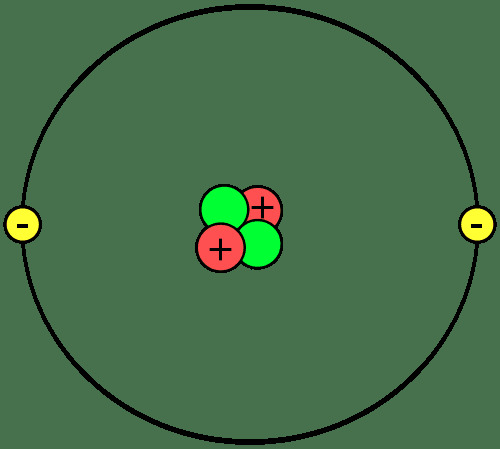
Aine ehitusplokid on aatomid, mis ühinevad moodustades molekule või ühendeid. Oluline on teada aatomi osi, mis ioonid ja isotoobid on ning kuidas aatomid omavahel ühinevad.
Aatomi osad
Aatomid koosnevad kolmest komponendist:
- prootonid - positiivne elektrilaeng
- neutronid - elektrilaeng puudub
- elektronid - negatiivne elektrilaeng
Prootonid ja neutronid moodustavad iga aatomi tuuma või keskpunkti. Elektronid tiirlevad tuuma ümber. Niisiis, iga aatomi tuumas on neto positiivne laeng, aatomi välimisel osal on aga negatiivne netolaeng. Keemiliste reaktsioonide käigus aatomid kaotavad, võidavad või jagavad elektrone. Tuum ei osale tavalistes keemilistes reaktsioonides, ehkki tuuma lagunemine ja tuumareaktsioonid võivad põhjustada muutusi aatomituumas.
Aatomid, ioonid ja isotoobid
Prootonite arv aatomis määrab, milline element see on. Igal elemendil on ühe- või kahetäheline
sümbol mida kasutatakse selle tuvastamiseks keemilistes valemites ja reaktsioonides. Heeliumi sümbol on Ta. Kahe prootoniga aatom on heeliumi aatom, sõltumata sellest, mitu neutronit või elektronit see on. Aatomil võib olla sama arv prootoneid, neutroneid ja elektrone või neutronite ja / või elektronide arv võib erineda prootonite arvust.Aatomid, mis kannavad neto positiivset või negatiivset elektrilaengut, on ioonid. Näiteks kui heeliumi aatom kaotab kaks elektroni, siis oleks selle netolaeng +2, mis kirjutataks He2+.
Neutronite arvu muutumine aatomis määrab millise isotoop elemendi see on. Aatomid võivad olla kirjutatud tuumasümbolitega, et tuvastada nende isotoop, kus nukleonide arv (prootonid pluss neutronid) on loetletud ülalpool ja elemendi sümbolist vasakul koos allpool loetletud prootonite arvuga ja vasakul sümbol. Näiteks on vesiniku kolm isotoopi:
11H, 21H, 31H
Kuna teate, et prootonite arv ei muutu kunagi elemendi aatomi korral, kirjutatakse isotoobid sagedamini elemendi sümboli ja nukleonide arvu järgi. Näiteks võite kirjutada H-1, H-2 ja H-3 vesiniku kolme isotoobi kohta või U-236 ja U-238 kahe tavalise uraani isotoobi jaoks.
Aatomiarv ja aatomkaal
aatomnumber aatomi tuvastab selle elemendi ja prootonite arvu. aatommass on prootonite arv pluss neutronite arv elemendis (kuna elektronide mass on võrreldes prootonite ja neutronitega nii väike, et seda sisuliselt ei loeta). Aatommassi nimetatakse mõnikord aatommassiks või aatommassi numbriks. Heeliumi aatomnumber on 2. Heeliumi aatommass on 4. Pange tähele, et perioodilise tabeli elemendi aatommass ei ole täisarv. Näiteks heeliumi aatommass on 4,003, mitte 4. Seda seetõttu, et perioodiline tabel kajastab elemendi isotoopide looduslikku arvukust. Keemiaarvutustes kasutate perioodilisel tabelil toodud aatommassi, eeldades, et elemendi proov kajastab selle elemendi looduslikku isotoopide vahemikku.
Molekulid
Aatomid interakteeruvad üksteisega, moodustades sageli üksteisega keemilisi sidemeid. Kui kaks või enam aatomit seovad üksteist, moodustavad nad molekuli. Molekul võib olla lihtne, näiteks H2või keerukamad, näiteks C6H12O6. Alamjärjestused tähistavad molekulis igat tüüpi aatomite arvu. Esimene näide kirjeldab molekuli, mille moodustavad kaks vesiniku aatomit. Teine näide kirjeldab molekuli, mis koosneb 6 süsinikuaatomist, 12 vesinikuaatomist ja 6 hapnikuaatomist. Ehkki aatomeid saate kirjutada suvalises järjekorras, on tava kirjutada esmalt molekuli positiivselt laetud minevik, millele järgneb molekuli negatiivselt laetud osa. Naatriumkloriid kirjutatakse NaCl, mitte ClNa.
Perioodilise tabeli märkused ja ülevaade
Periooditabel on keemia oluline tööriist. Need märkused annavad ülevaate perioodilisustabelist, selle korraldusest ja perioodilise tabeli suundumustest.
Perioodilise tabeli leiutamine ja korraldamine
Aastal 1869 Dmitri Mendelejev organiseeris keemilised elemendid perioodiliseks tabeliks, sarnaselt täna kasutatavaga, välja arvatud tema elemendid telliti kasvava aatommassi järgi, samas kui tänapäevane tabel on korraldatud aatomi suurendamise teel number. Elementide korraldus võimaldab näha elementide omaduste suundumusi ja ennustada elementide käitumist keemilistes reaktsioonides.
Ridasid (liiguvad vasakult paremale) kutsutakse perioodid. Perioodi elementidel on sama kõrgeim energiatase elektrita. Energiataseme kohta on alatasemeid rohkem, kui aatomi suurus suureneb, seega on tabelis allpool olevate perioodide vahel rohkem elemente.
Veerud (ülevalt alla liikuvad) moodustavad elemendi aluse rühmad. Rühmade elementidel on sama arv valentselektrone või välimise elektronkesta kestust, mis annab rühma elementidele mitu ühist omadust. Elementide rühmade näideteks on leelismetallid ja väärisgaasid.
Perioodilise tabeli trendid või perioodilisus
Perioodilise tabeli korraldus võimaldab lühidalt näha elementide omaduste suundumusi. Olulised suundumused on seotud aatomi raadiuse, ionisatsioonienergia, elektronegatiivsuse ja elektronide afiinsusega.
-
Aatomraadius
Aatomi raadius peegeldab aatomi suurust. Aatomi raadius väheneb liikumine vasakult paremale kogu perioodi jooksul ja suurendab liikumist ülalt alla elementide rühma alla. Ehkki võite arvata, et aatomid muutuvad lihtsalt suuremaks, kui nad saavad rohkem elektrone, jäävad elektronid kestasse, samal ajal kui suurenev prootonite arv tõmbab kestasid tuumale lähemale. Rühmast allapoole liikudes leitakse elektronid tuumadest kaugemal uutes energiakestades, seega aatomi üldine suurus suureneb. -
Ionisatsioonienergia
Ionisatsioonienergia on energia hulk, mis on vajalik elektri eemaldamiseks ioonist või aatomist gaasi olekus. Ionisatsioonienergia suurendab liikumist vasakult paremale kogu perioodi jooksul ja väheneb liikumine ülalt alla alla rühma. -
Elektronegatiivsus
Elektronegatiivsus mõõdab, kui kergesti aatom moodustab keemilise sideme. Mida suurem on elektronegatiivsus, seda suurem on elektronide sidumise atraktsioon. Elektronegatiivsus väheneb elemendirühma alla liikumine. Perioodilise tabeli vasakpoolses servas olevad elemendid on tavaliselt elektropositiivsed või loovutavad tõenäolisemalt elektroni kui seda. -
Elektronide afiinsus
Elektronide afiinsus kajastab, kui kergesti aatom võtab elektronid vastu. Elektronide afiinsus varieerub vastavalt elementide rühmale. Väärisgaasidel on elektronide afiinsus nullilähedane, kuna nad on täitnud elektronide kesta. Halogeenidel on kõrge elektronide afiinsus, kuna elektroni lisamine annab aatomile täielikult täidetud elektronkesta.
Keemilised sidemed ja liimimine

Keemilised sidemed on hõlpsasti mõistetav, kui pidada silmas järgmisi aatomite ja elektronide omadusi:
- Aatomid otsivad kõige stabiilsemat konfiguratsiooni.
- Oktetreegel väidab, et kõige stabiilsemad on aatomid, mille välimises orbitaalis on 8 elektronit.
- Aatomid saavad jagada, anda või võtta teiste aatomite elektrone. Need on keemiliste sidemete vormid.
- Sidemed tekivad aatomite valentselektronite, mitte sisemiste elektronide vahel.
Keemiliste sidemete tüübid
Kaks peamist keemiliste sidemete tüüpi on ioon- ja kovalentsed sidemed, kuid peaksite olema teadlik mitmest sidumisviisist:
-
Ioonilised võlakirjad
Ioonilised sidemed moodustatakse siis, kui üks aatom võtab teisest aatomist elektroni. Näide: NaCl moodustub ioonse sidemega, kus naatrium annetab oma valentselektroni klooriks. Kloor on halogeen. Kõigil halogeenidel on 7 valentselektroni ja stabiilse okteti saamiseks on vaja veel ühte. Naatrium on leelismetall. Kõigil leelismetallidel on 1 valentselektron, mille nad annetavad kergesti sideme moodustamiseks. -
Kovalentsed võlakirjad
Kovalentsed sidemed moodustuvad, kui aatomid jagavad elektrone. Tegelikult on peamine erinevus selles, et ioonsetes sidemetes olevad elektronid on tihedamalt seotud ühe aatomiga tuum või teine, millised elektronid kovalentses sidemes tiirlevad umbes sama tõenäosusega kui üks tuum muud. Kui elektron on ühe aatomiga tihedamalt seotud kui teine, a polaarne kovalentne side võib moodustada. Näide: vesiniku ja vees oleva hapniku vahel moodustuvad kovalentsed sidemed, H2O -
Metalliline võlakiri
Kui mõlemad aatomid on metallid, moodustub metalliline side. Metalli erinevus seisneb selles, et elektronid võivad olla mis tahes metalli aatomid, mitte ainult kaks aatomit ühendis. Näide: Puhaselemente, näiteks kulda või alumiiniumi, või sulameid, nagu messing või pronks, võib näha metallisidemeid.
Teil võib tekkida küsimus, kuidas saate teada, kas side on iooniline või kovalentne. Võite vaadata elementide paigutust perioodilisele tabelile või elementide tabelile elektronegatiivsused ennustada moodustuva sideme tüüpi. Kui elektronegatiivsuse väärtused on üksteisest väga erinevad, moodustub iooniline side. Tavaliselt on katioon metall ja anioon mittemetall. Kui mõlemad elemendid on metallid, eeldatakse, et moodustub metalliline side. Kui elektronegatiivsuse väärtused on sarnased, võib tekkida kovalentne side. Võlakirjad kahe mittemetallide vahel on kovalentsed võlakirjad. Polaarsed kovalentsed sidemed moodustuvad elementide vahel, millel on elektronegatiivsuse väärtuste vahelised erinevused.
Kuidas ühendeid nimetada - keemia nomenklatuur
Keemikute ja teiste teadlaste omavaheliseks suhtlemiseks leppis Rahvusvahelise Puhta ja Rakenduskeemia Liit ehk IUPAC kokku nomenklatuurisüsteemis või nimetamises. Kuulete kemikaale, mida nimetatakse nende üldnimedeks (nt sool, suhkur ja söögisooda), kuid laboris kasutaksite süstemaatilisi nimetusi (nt naatriumkloriid, sahharoos ja naatriumvesinikkarbonaat). Siin on ülevaade mõnest nomenklatuuri põhipunktist.
Binaarsete ühendite nimetamine
Ühendid võivad koosneda ainult kahest elemendist (binaarsed ühendid) või enam kui kahest elemendist. Binaarsete ühendite nimetamisel kehtivad teatud reeglid:
- Kui üks elementidest on metall, nimetatakse seda esimeseks.
- Mõned metallid võivad moodustada rohkem kui ühte positiivset iooni. Tavaline on, et ioonil laetakse rooma numbreid. Näiteks FeCl2 on raud (II) kloriid.
- Kui teine element on mittemetall, on ühendi nimi metallinimi, millele järgneb mittemetalli nime tüvi (lühend), millele järgneb "ide". Näiteks nimetatakse NaCl naatriumkloriidiks.
- Kahest mittemetallist koosnevate ühendite puhul nimetatakse kõigepealt elektropositiivsemat elementi. Teise elemendi tüvele antakse nimi, millele järgneb "ide". Näitena võib tuua HCl, mis on vesinikkloriid.
Ioonsete ühendite nimetamine
Lisaks binaarsete ühendite nimetamise reeglitele on ioonsete ühendite jaoks ka täiendavad nimetamismeetodid:
- Mõned polüatomilised anioonid sisaldavad hapnikku. Kui element moodustab kaks oksüaniooni, lõpeb üks, milles on vähem hapnikku, inaat, teine aga, milles on rohkem hapniku. Näiteks:
EI2- on nitrit
EI3- on nitraat