Valentsideme (VB) teooria on keemilise sidumise teooria, mis selgitab kemikaali liimimine kahe vahel aatomid. Sarnaselt molekulaarse orbitaalteooriaga (MO) selgitab see sidumist kvantmehaanika põhimõtteid kasutades. Valentssideme teooria kohaselt põhjustab seostumine poolenisti täidetud aatomi kattumisega orbitaalid. Kaks aatomit jagage üksteise paarimata elektronid, et moodustada täidetud orbitaal, moodustades a hübriidorbitaal ja ühendage omavahel. Sigma ja pi võlakirjad on valentssideme teooria osa.
Võtmeisikud: valentside võlakirjade (VB) teooria
- Valentsidemete teooria ehk VB teooria on kvantmehaanikal põhinev teooria, mis selgitab, kuidas keemiline sidumine töötab.
- Valentssideme teoorias ühendatakse üksikute aatomite aatomorbitaalid keemiliste sidemete moodustamiseks.
- Teine peamine keemilise sideme teooria on molekulaarse orbitaalteooria või MO-teooria.
- Valentssideme teooriat kasutatakse selleks, et selgitada, kuidas mitme molekuli vahel moodustuvad kovalentsed keemilised sidemed.
Teooria
Valentssideme teooria ennustab kovalentse sideme moodustumist aatomite vahel, kui neis on poolenisti täidetud valentsusega aatomorbitaalid, millest igaüks sisaldab ühte paarita elektroni. Need aatomorbitaalid kattuvad, seega on elektronidel kõige suurem tõenäosus viibida sideme piirkonnas. Seejärel jagavad mõlemad aatomid üksikuid paarimata elektrone, moodustades nõrgalt ühendatud orbitaale.
Kaks aatomorbitaali ei pea olema üksteisega samad. Näiteks sigma- ja pi-sidemed võivad kattuda. Sigma sidemed moodustuvad, kui kahel jagatud elektronil on orbitaalid, mis kattuvad pea-pea vahel. Seevastu pi-sidemed tekivad siis, kui orbitaalid kattuvad, kuid on üksteisega paralleelsed.
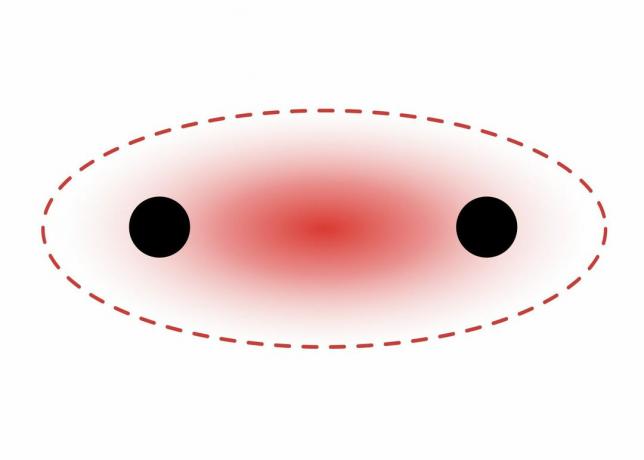
Sigma sidemed moodustuvad kahe s-orbitaali elektronide vahel, kuna orbitaalkuju on sfääriline. Üksiksidemed sisaldavad ühte sigma-sidet. Kaksiksidemed sisaldavad sigma- ja pi-sidet. Kolmiksidemed sisaldavad sigma- ja kahte pi-sidet. Kui aatomite vahel moodustuvad keemilised sidemed, võivad aatomorbitaalid olla sigma- ja pi-sidemete hübriidid.
Teooria aitab selgitada sidemete moodustumist juhtudel, kui a Lewise struktuur ei saa kirjeldada reaalset käitumist. Sel juhul võib ühe Lewise stringi kirjeldamiseks kasutada mitut valentssideme struktuuri.
Ajalugu
Valentssideme teooria põhineb Lewise struktuuridel. G.N. Lewis pakkus need struktuurid välja 1916. aastal, tuginedes ideele, et kaks ühiselt liikuvat elektroni moodustasid keemilisi sidemeid. Sidemete omaduste kirjeldamiseks 1927. aasta Heitleri-Londoni teoorias rakendati kvantmehaanikat. See teooria kirjeldas keemilise sideme moodustumist vesinikuaatomite vahel H2 molekulis, kasutades Schrödingeri lainevõrrandit kahe vesinikuaatomi lainefunktsioonide liitmiseks. 1928. aastal ühendas Linus Pauling Lewise paarissidemise idee Heitleri-Londoni teooriaga, et pakkuda välja valentsidemete teooria. Valentssideme teooria töötati välja resonantsi ja orbitaalse hübridisatsiooni kirjeldamiseks. Aastal 1931 avaldas Pauling valentssidemete teooria kohta raamatu pealkirjaga "Keemilise sideme olemuse kohta". Esimesed kasutatud arvutiprogrammid keemilise sideme kirjeldamiseks kasutatud molekulaarsel orbitaalteoorial, kuid alates 1980. aastatest on muutunud valentssideme teooria põhimõtted programmeeritav. Tänapäeval on nende teooriate kaasaegsed versioonid üksteisega konkureerivad tõelise käitumise täpse kirjeldamise osas.
Kasutab
Valentsidemete teooria võib sageli selgitada, kuidas kovalentsed sidemed vorm. diatomiline fluori molekul, F2, on näide. Fluori aatomid moodustavad üksteisega üksikud kovalentsed sidemed. F-F-side tuleneb kattumisest lkz orbitaalid, mis kõik sisaldavad ühte paarimata elektroni. Sarnane olukord on vesinikus, H2, kuid sidemete pikkused ja tugevus on H vahel erinevad2 ja F2 molekulid. Vesinikfluoriidhappes (HF) moodustub vesiniku ja fluori vahel kovalentne side. See side moodustub vesiniku 1 kattumisests orbitaal ja fluor 2lkz orbitaal, millel kõigil on paarimata elektron. HF-s jagavad nii vesiniku kui ka fluori aatomid neid elektrone kovalentses sidemes.
Allikad
- Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "Benseeni molekuli elektrooniline struktuur." Loodus. 323 (6090): 699. doi:10.1038 / 323699a0
- Messmer, Richard P.; Schultz, Peter A. (1987). "Benseeni molekuli elektrooniline struktuur." Loodus. 329 (6139): 492. doi:10.1038 / 329492a0
- Murrell, J.N.; Kettle, S.F.A.; Tedder, J. M. (1985). Keemiline võlakiri (2. väljaanne). John Wiley ja pojad. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Benseeni molekuli elektrooniline struktuur." Loodus. 325 (6103): 396. doi:10.1038 / 325396d0
- Shaik, Sason S.; Phillipe C Hiberty (2008). Valentse Bondi teooria keemikute juhend. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.